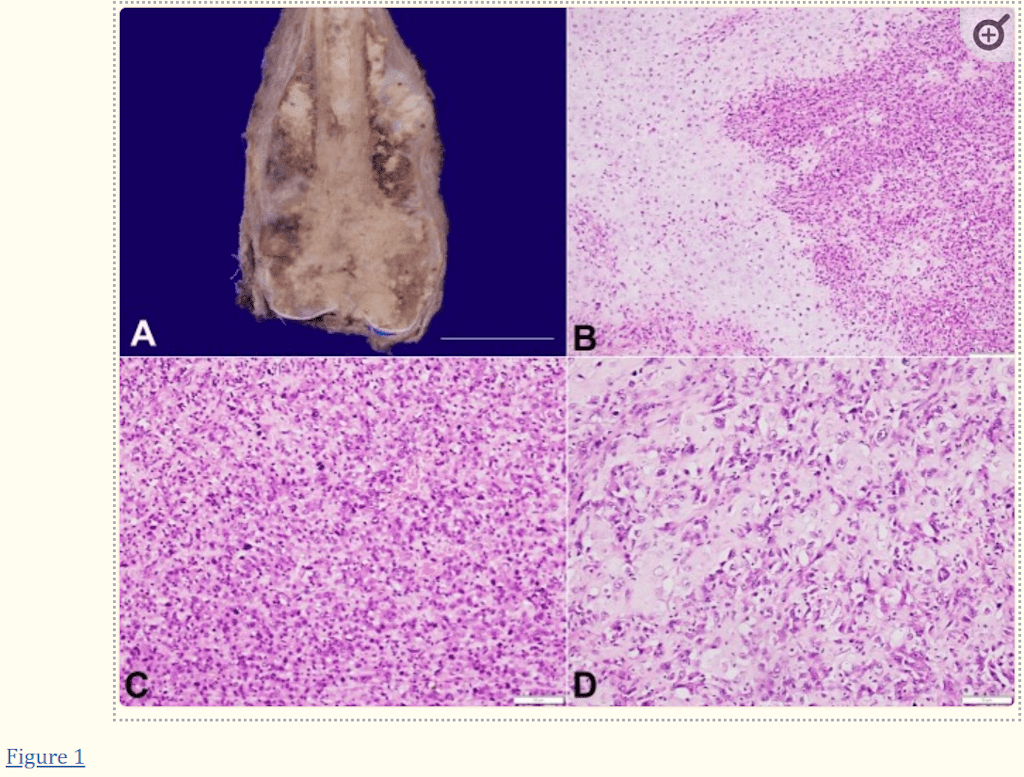
Imagenología Multimodal del Osteosarcoma: Del Diagnóstico Inicial a la Radiómica
Resumen Simple
El
osteosarcoma es un tumor óseo maligno primario que produce una matriz
osteoide. La imagenología es crucial para su detección, caracterización y
planificación del tratamiento, aunque puede ser compleja, especialmente
en las etapas iniciales. La radiografía convencional suele ser la
primera modalidad utilizada para detectar hallazgos sospechosos,
mientras que el sistema Bone-RADS ayuda a describir los resultados de la
imagenología y a estratificar el riesgo. La TC proporciona información
detallada sobre la arquitectura ósea y la matriz osteoide, mientras que
la RMN es esencial para evaluar la propagación del tumor a los tejidos
blandos adyacentes, el canal medular, las articulaciones y las
estructuras neurovasculares. Esta revisión incluye ejemplos de casos
clínicos y explora el papel de la inteligencia artificial en la mejora
del diagnóstico del osteosarcoma.

Resumen
El osteosarcoma
es un tumor óseo maligno primario que se caracteriza por la producción
de una matriz osteoide. Si bien la histología sigue siendo el estándar
diagnóstico definitivo, la imagenología desempeña un papel crucial en el
diagnóstico, la planificación terapéutica y el seguimiento. La
radiografía convencional sirve como punto de control inicial para la
detección de esta patología, que a menudo presenta dificultades
diagnósticas debido a síntomas vagos e inespecíficos, especialmente en
sus etapas iniciales. Hoy en día, la integración de diferentes técnicas
de imagen permite un diagnóstico y un tratamiento cada vez más
personalizados, cada una de las cuales aporta información única y
complementaria. La radiografía convencional suele iniciar la evaluación
por imagen, y el Sistema de Informes y Datos Óseos (Bone-RADS) de la
Sociedad de Radiología Esquelética (SSR) es una herramienta valiosa para
estratificar el riesgo de lesiones óseas sospechosas. La TC es la
modalidad preferida para evaluar la matriz ósea, mientras que las
gammagrafías óseas y la PET/TC son eficaces para detectar metástasis a
distancia. La RM revela la extensión de la lesión en los tejidos blandos
adyacentes, el canal medular y las articulaciones, así como su relación
con las estructuras neurovasculares y la presencia de lesiones
salteadas. Técnicas avanzadas como la resonancia magnética con contraste
dinámico (DCE-MRI), la resonancia magnética ponderada por difusión
(DWI) y la RM de perfusión ayudan a caracterizar el entorno tumoral y a
evaluar la respuesta al tratamiento. El osteosarcoma comprende diversos
subtipos con diferentes características clínicas y de imagen, algunos de
los cuales son particularmente distintivos, como en el caso del
osteosarcoma telangiectásico. El conocimiento de estas variantes puede
orientar a los radiólogos en el diagnóstico diferencial, que incluye
tanto formas centrales como superficiales, desde tipos muy agresivos
hasta los más indolentes. En esta revisión, presentamos una amplia gama
de casos representativos de nuestra serie de casos hospitalarios para
ilustrar presentaciones de imagen típicas y atípicas. Finalmente,
analizamos los avances y desafíos recientes en la aplicación de enfoques
de inteligencia artificial a la imagenología del osteosarcoma.
Introducción
El
osteosarcoma es un tumor óseo primario caracterizado por células
mesenquimales que producen una matriz osteoide [1,2]. Es el cáncer óseo
primario más común que no afecta a las células sanguíneas [1,2]. Aunque
es poco frecuente en la población general, con una tasa de incidencia de
aproximadamente 4 a 5 casos por millón de personas al año (menos del 1%
de todos los casos de cáncer) [1,3], estudios epidemiológicos a gran
escala han revelado un aumento de su incidencia en las últimas décadas
[4]. Tradicionalmente, el osteosarcoma se ha considerado un tumor con
una incidencia bimodal, con un pico primario en niños y adolescentes y
un pico secundario en personas mayores de 80 años [1,4]. Sin embargo,
estudios recientes cuestionan el patrón bimodal típico, sugiriendo en
cambio un único pico de incidencia constante en la segunda década de la
vida [5]. En niños y adolescentes, representa el tumor mesenquimal
maligno primario más común, representando aproximadamente el 80% de
todos los tumores óseos malignos y aproximadamente el 2,4% de todos los
cánceres infantiles [1]. En personas mayores de cincuenta años, el
osteosarcoma representa aproximadamente el 50% de todos los tumores
óseos malignos primarios, con una mayor proporción de osteosarcomas
secundarios [2]. Es más común en hombres que en mujeres, con una
proporción hombre-mujer de aproximadamente 1,5:1 a 2:1 [4]. Aunque
algunos estudios sugieren variaciones en la incidencia entre diferentes
grupos étnicos, con tasas más altas reportadas en poblaciones negras e
hispanas, los datos globales siguen siendo inconsistentes [4]. Los
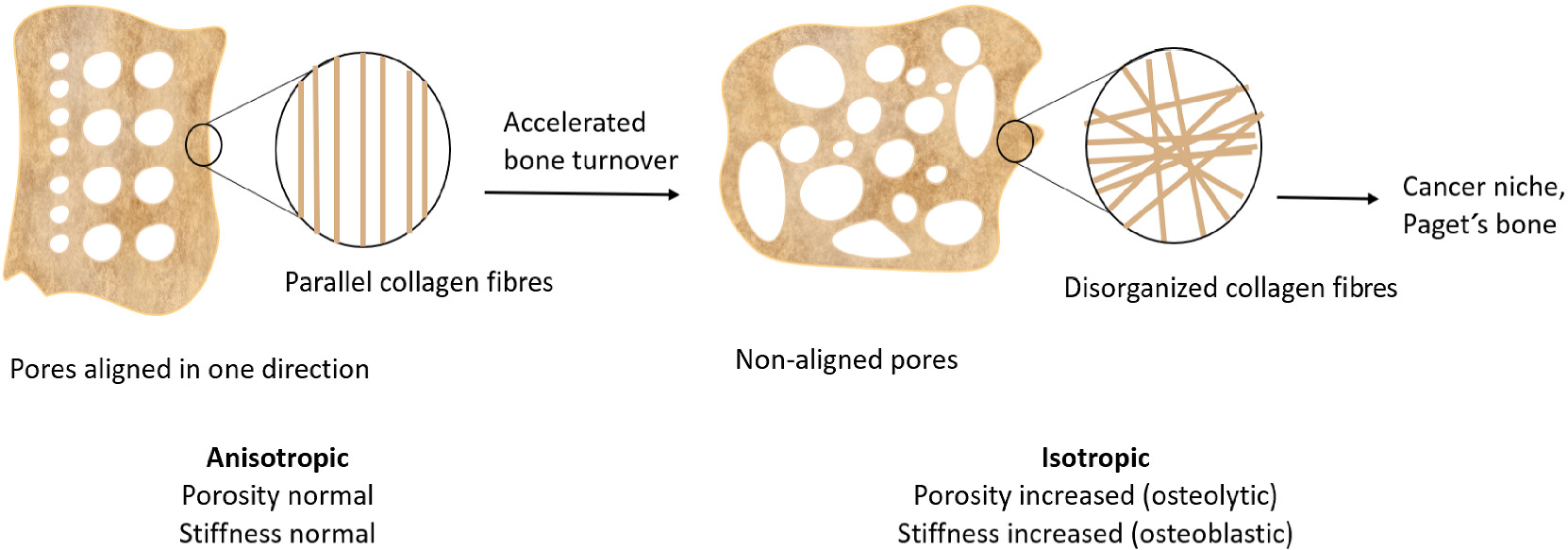
factores de riesgo para este tumor incluyen exposición previa a
radiación terapéutica, como la causada por tratamiento contra el cáncer,
estatura alta, alto peso al nacer y afecciones como la enfermedad de
Paget o exostosis múltiples hereditarias, que implican un rápido
crecimiento o recambio óseo y también pueden aumentar el riesgo de
desarrollar osteosarcoma [4,6]. Se ha vinculado a varios síndromes de
predisposición al cáncer, como el retinoblastoma hereditario (asociado
con mutaciones del gen RB1) [7,8], el síndrome de Li-Fraumeni
(relacionado con mutaciones del gen TP53) [9,10] y variantes germinales
patogénicas en individuos con osteosarcoma, especialmente en jóvenes
[11].
El osteosarcoma se presenta con mayor frecuencia cerca de la metáfisis de los huesos largos, en particular alrededor de la articulación de la rodilla [12]. El fémur es la zona afectada con mayor frecuencia, representando aproximadamente el 42-46% de los casos, seguido de la tibia (alrededor del 19-24%) y el húmero (alrededor del 10-12%). En adultos mayores, el osteosarcoma también puede presentarse en otros huesos, como la pelvis, las costillas y la mandíbula [2]. La clasificación de tumores de tejidos blandos y huesos de la Organización Mundial de la Salud (OMS) reconoce varios tipos de osteosarcomas con diferentes grados de malignidad [13]. Clínicamente, el osteosarcoma se presenta típicamente con dolor profundo que empeora progresivamente [14]. Otros síntomas pueden incluir una masa palpable y restricción del movimiento, y en el 5-10 % de los casos, el tumor puede provocar una fractura patológica.
Las imágenes desempeñan un papel crucial en la detección, el diagnóstico y la estadificación del osteosarcoma [12,15,16]. Aunque estos tumores suelen mostrar características de imagen agresivas, el diagnóstico inicial puede ser difícil y sutil, especialmente en las primeras etapas, donde pueden confundirse con lesiones benignas o lesiones con bajo potencial maligno [14,15]. Los retrasos en el diagnóstico pueden ocurrir porque síntomas como el dolor localizado o la inflamación a menudo se atribuyen a afecciones benignas, incluyendo lesiones deportivas o dolores de crecimiento en pacientes más jóvenes [16]. Si bien la radiografía convencional suele ser la primera técnica de imagen aplicada al análisis de tumores óseos como los osteosarcomas, la integración de la tomografía computarizada (TC) y la resonancia magnética (RM) es esencial para una caracterización precisa de las lesiones [17]. La tomografía computarizada (TC) proporciona una evaluación más completa de las estructuras óseas en comparación con la radiografía convencional, mientras que la resonancia magnética (RM) es especialmente valiosa para evaluar la extensión del tumor a los tejidos blandos circundantes [18]. Además, la gammagrafía ósea y la PET-TC desempeñan un papel importante en la estadificación y la planificación terapéutica [19].
La diversa presentación y la naturaleza agresiva del osteosarcoma requieren imágenes precisas tanto para el diagnóstico inicial como para el seguimiento de la respuesta al tratamiento, dadas las características complejas y variables del tumor. Por lo tanto, la integración de diversas modalidades de imagen es crucial para una evaluación exhaustiva del tumor y una planificación terapéutica eficaz (Tabla 1) [20]. En apoyo de la evaluación visual por parte de los radiólogos, la aplicación intensiva de la inteligencia artificial al análisis de imágenes biomédicas en la última década ha facilitado un cambio de paradigma en la imagenología oncológica [21]. La radiómica desempeña un papel prometedor al permitir la extracción de una amplia gama de características cuantitativas de las imágenes, lo que mejora el diagnóstico, la caracterización y la predicción de la respuesta terapéutica del tumor [22,23]. Sin embargo, a pesar de los avances tecnológicos y metodológicos que han superado algunos de los desafíos iniciales en la obtención de imágenes del cáncer, en particular en tumores de pulmón, mama y cerebro [21,24,25,26], en el estudio de los tumores óseos, la traducción clínica de estos modelos fue bastante limitada [27]. Por ello, el papel del radiólogo sigue siendo indispensable. Sin embargo, los radiólogos deben ser conscientes de estas nuevas oportunidades para contribuir activamente a la atención sanitaria continua.
Conclusiones
Los
osteosarcomas son tumores óseos primarios poco frecuentes, pero
agresivos, que requieren un diagnóstico preciso y un estudio de imagen
completo para un tratamiento eficaz. Aunque poco comunes, son los
tumores óseos malignos más frecuentes en niños y adolescentes, lo que
resalta la necesidad de una detección temprana. La clasificación
Bone-RADS ayuda a los radiólogos en la estratificación inicial del
riesgo de lesiones óseas, a menudo detectadas incidentalmente durante
estudios radiográficos. Los avances en imagenología, en particular la
resonancia magnética y la tomografía computarizada (TC), son
fundamentales para el diagnóstico, la estadificación y el seguimiento de
la supervivencia global, ofreciendo información detallada sobre las
características tumorales y guiando el tratamiento. Tecnologías
emergentes como la inteligencia artificial en radiómica y radiogenómica
son prometedoras para mejorar las capacidades diagnósticas, aunque su
aplicación clínica sigue limitada por los datos y los desafíos
metodológicos. A pesar del progreso tecnológico, la experiencia de los
radiólogos sigue siendo esencial para interpretar imágenes complejas y
garantizar resultados óptimos para los pacientes.
Multimodal Imaging of Osteosarcoma: From First Diagnosis to Radiomics – PubMed
Multimodal Imaging of Osteosarcoma: From First Diagnosis to Radiomics – PMC
Multimodal Imaging of Osteosarcoma: From First Diagnosis to Radiomics
Cè M, Cellina M, Ueanukul T, Carrafiello G, Manatrakul R, Tangkittithaworn P, Jaovisidha S, Fuangfa P, Resnick D. Multimodal Imaging of Osteosarcoma: From First Diagnosis to Radiomics. Cancers (Basel). 2025 Feb 10;17(4):599. doi: 10.3390/cancers17040599. PMID: 40002194; PMCID: PMC11852380.
Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).