https://www.ortopediaoncologicamexico.mx/academia/microambiente-oseo-y-metastasis-de-osteosarcoma-c/
Microambiente óseo y metástasis de osteosarcoma
El microambiente óseo está compuesto por médula ósea y una matriz
extracelular mineralizada. La médula ósea contiene dos tipos de células
diferentes: células madre hematopoyéticas con función hematopoyética y
células madre mesenquimales de la médula ósea, que son responsables de
diferenciarse en componentes no celulares de la sangre en el hueso,
incluidas células madre mesenquimales (MSC), osteoblastos, osteoclastos,
osteocitos, fibroblastos, células grasas, etc. [1,2,3]. El
microambiente óseo proporciona un sitio ideal para que prosperen muchos
tipos distintos de cáncer. Por ejemplo, algunos tumores secundarios que
se originan en otros sitios tienden a difundirse hacia el hueso,
incluidos el cáncer de mama, el cáncer de próstata, etc. [4,5,6]. El
concepto de “círculo vicioso” ha estado presente desde la década de 1990
para describir esta estrecha conexión entre las células tumorales
metastásicas y las células óseas [7]. Las células tumorales invaden el
hueso, lo que provoca la pérdida del equilibrio entre la formación y la
resorción ósea [4,5].
El microambiente óseo es también un suelo fértil y un sistema biológico complejo que facilita la metástasis de muchos cánceres, incluido el osteosarcoma (OS) [8,9]. En los últimos años, para comprender el progreso de la OS, varios estudios se han centrado en la relación entre la OS y el microambiente óseo, por ejemplo, las MSC, que son uno de los miembros más importantes del microambiente óseo [10]. Aquí, resumimos los enfoques de investigación sobre el microambiente óseo y la metástasis del sistema operativo. Revisamos el efecto promotor de los componentes principales del microambiente óseo sobre la metástasis del sistema operativo, como las células madre mesenquimales, la hipoxia, la acidosis y las quimiocinas. Mientras tanto, estábamos particularmente preocupados por las vías de señalización activadas por estos factores en el microambiente óseo y las consecuencias para el progreso de la metástasis del sistema operativo.
OS es el principal tumor óseo primario maligno en adultos jóvenes y niños. Las regiones metafisarias de los huesos largos, los sitios más activos del hueso, son los principales sitios de crecimiento del sistema operativo [11]. La gran heterogeneidad tumoral en la OS crea algunos problemas difíciles para la terapia tumoral, como la identificación de biomarcadores confiables, el reconocimiento del mecanismo de recurrencia y la identificación de qué tipo de célula causa la OS [12]. La forma convencional de OS se puede dividir en subtipos distintivos basados en en el análisis histológico: tipos osteoblásticos, fibroblásticos, condroblásticos, epitelioides, ricos en células gigantes, de células pequeñas y telangiectásicos [13]. Aunque las características morfológicas son diferentes, la investigación convencional cree que la OS surge en los osteoides generados a partir de células madre mesenquimales, así como en preosteoblastos o precursores de osteoblastos [14]. Por ejemplo, algunos artículos informaron que la eliminación de TP53 y Rb puede causar la transformación OS de los osteoblastos [15,16,17]. La pérdida de Rb puede desencadenar la transformación de las MSC en OS, y la sobreexpresión de C-myc también tiene consecuencias similares para las MSC [18]. La patogénesis molecular de la OS es complicada, pero a pesar de ello, hay algunos genes clave que se han estudiado y pueden darnos un poco de inspiración. TP53 y Rb son los genes con mayor frecuencia de ausencia y mutaciones en modelos de OS humanos y de ratones transgénicos. Tanto TP53 como Rb son genes supresores de tumores y participan en la regulación del ciclo celular, mientras que TP53 participa en la apoptosis celular. Hay otros genes con expresión aberrante en OS, incluidos c-myc, AP-1, c-fos, TWIST, MMP, IGF-1, etc. [19,20,21,22].
La metástasis tumoral es el principal problema de la terapia tumoral [23]. La mayoría de los OS se infiltran en el tejido circundante e incluso metastatizan en el pulmón cuando se encuentran. La metástasis pulmonar es el principal desafío para la terapia con OS; sin embargo, debido a la introducción de la quimioterapia, la tasa de supervivencia a cinco años de la SG ha aumentado a aproximadamente el 70% desde la década de 1970, pero la tasa de supervivencia a cinco años sigue siendo tan baja como el 20-30% después de la metástasis pulmonar [24]. El estudio de cómo el microambiente tumoral afecta la propagación y la metástasis de la OS aún no está en profundidad. Las células OS malignas forman una mezcla compleja con otras células normales (MSC, fibroblastos, osteoblastos y células inmunes mieloides) y algunos factores químicos (hipoxia, acidosis). Este microambiente tumoral especial de la mezcla compleja es un lugar perfecto para que OS se desarrolle y metastatice. Al comprender este microambiente óseo especial, se puede comprender mejor el mecanismo de la metástasis del OS y es posible encontrar un objetivo terapéutico para el tratamiento de la metástasis del OS.
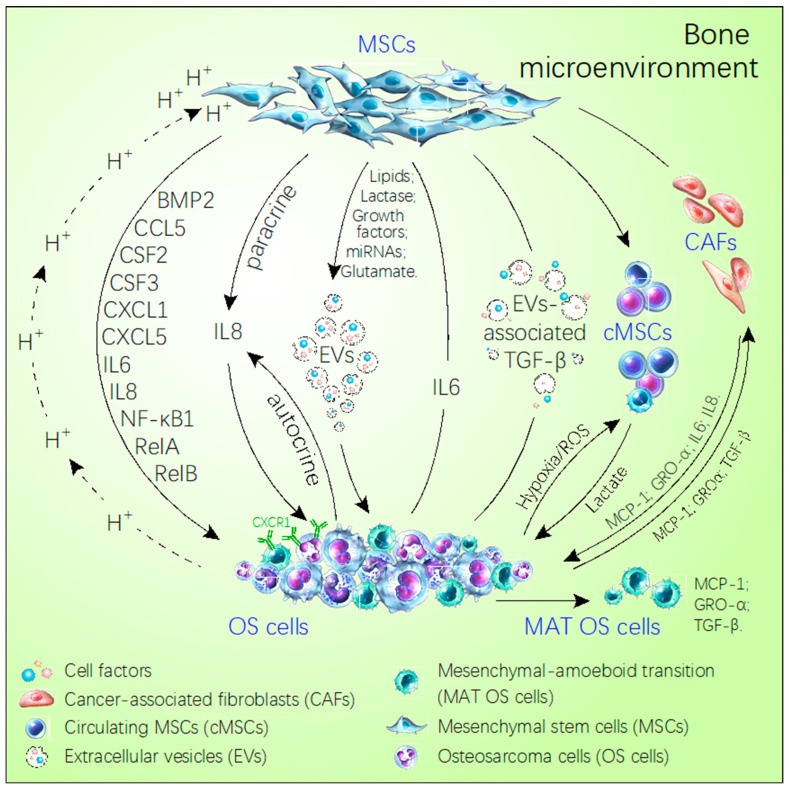
El microambiente óseo es un suelo fértil ideal para que se
siembren tumores primarios y secundarios. La aparición y desarrollo del
osteosarcoma, como tumor óseo primario, está estrechamente relacionado
con el microambiente óseo. Especialmente, la metástasis del osteosarcoma
es el desafío restante de la terapia y el mal pronóstico. Cada vez hay
más evidencia que se centra en la relación entre el microambiente óseo y
la metástasis del osteosarcoma. Existen muchos elementos en el
microambiente óseo, como ácidos, hipoxia y quimiocinas, que se ha
verificado que afectan la progresión y la malignidad del osteosarcoma a
través de diversas vías de señalización. En consecuencia, resumimos
minuciosamente todos estos reguladores en el microambiente óseo y las
cascadas de transmisión, intentando proporcionar sugerencias para
inhibir la metástasis del osteosarcoma mediante la mejora del
microambiente óseo. Además, el análisis de la interacción entre el
microambiente óseo y el osteosarcoma nos ayudará a comprender en
profundidad el desarrollo del osteosarcoma. Los protagonistas celulares y
moleculares presentados en el microambiente óseo que promueven la
metástasis del osteosarcoma acelerarán la exploración de nuevas
estrategias terapéuticas contra el osteosarcoma.
Conclusiones y perspectivas
Estudios anteriores demostraron que el
microambiente óseo promueve la metástasis o la malignidad del sistema
operativo. En esta revisión, revisamos brevemente el sistema operativo y
el microambiente óseo; discutieron principalmente la función de las
células madre mesenquimales, la acidosis, la hipoxia y las quimiocinas
en el microambiente para promover la migración, la invasión y la
metástasis pulmonar del sistema operativo; y resumió ampliamente las
vías de señalización activadas en el sistema operativo que facilitan la
metástasis del sistema operativo, incluidas las vías de señalización
PI3K/Akt, Wnt/β-Catenin, MAPK/ERK, Hedgehog y Notch. Descubrimos que la
función de las células madre mesenquimales y las quimiocinas son puntos
importantes en la investigación de la OS y también son los factores más
importantes en el microambiente óseo para promover el progreso de la OS.
Siempre hay algunas interferencias entre las diferentes vías en la
aparición y el desarrollo de tumores, lo que proporciona una comprensión
integral de la aparición y el desarrollo de tumores. Además, el eje
IL-8/CXCR1 y el eje CXCL12/CXCR4/CXCR7 se activan comúnmente en el
microambiente óseo cuando se produce metástasis del sistema operativo
[29,31,33,39,53]. IL-8 y CXCL12, como moléculas secretadas, se detectan
fácilmente a través de la sangre periférica. IL-8 y CXCL12 pueden ser
biomarcadores de metástasis del sistema operativo y el eje IL-8/CXCR1 y
el eje CXCL12/CXCR4/CXCR7 pueden ser objetivos terapéuticos potenciales
para la metástasis del sistema operativo en el futuro.
Bone Microenvironment and Osteosarcoma Metastasis – PubMed (nih.gov)
Bone Microenvironment and Osteosarcoma Metastasis – PMC (nih.gov)
IJMS | Free Full-Text | Bone Microenvironment and Osteosarcoma Metastasis (mdpi.com)
Yang C, Tian Y, Zhao F, Chen Z, Su P, Li Y, Qian A. Bone Microenvironment and Osteosarcoma Metastasis. Int J Mol Sci. 2020 Sep 23;21(19):6985. doi: 10.3390/ijms21196985. PMID: 32977425; PMCID: PMC7582690.
Copyright © 2020 by the authors.