Tratamiento de las lesiones cartilaginosas de la rodilla: estado actual
Tratamiento de las lesiones cartilaginosas de la rodilla: estado actual

Introducción
Las lesiones de cartílago en la rodilla constituyen un importante reto para el cirujano ortopédico, debido principalmente al carácter hialino del tejido, su escasa vascularización y limitada capacidad de reparación espontánea. (PubMed) Los autores señalan que para preservar la articulación y evitar la progresión hacia la artrosis es esencial comprender las diferentes modalidades terapéuticas disponibles. (PMC)
Métodos
Se trata de una revisión narrativa del estado actual de los tratamientos para las lesiones del cartílago de la rodilla. Los autores recopilan la literatura disponible, identifican tres grandes estrategias terapéuticas —“condroprotección”, “condroreparación” y “condrogeneración”— y analizan sus indicaciones, resultados, ventajas y limitaciones. (PubMed) Además, se consideran variables clínicas relevantes (tamaño y localización de la lesión, edad del paciente, carga mecánica, alineación, lesiones asociadas) que condicionan la elección terapéutica. (Mattioli 1885)
Resultados
Los hallazgos clave de la revisión son:
- En la modalidad de condroprotección, se incluyen intervenciones no invasivas o poco invasivas destinadas a reducir el daño progresivo del cartílago y preservar la articulación (por ejemplo medidas de descarga, fisioterapia, estabilización meniscal/ligamentosa). (PMC)
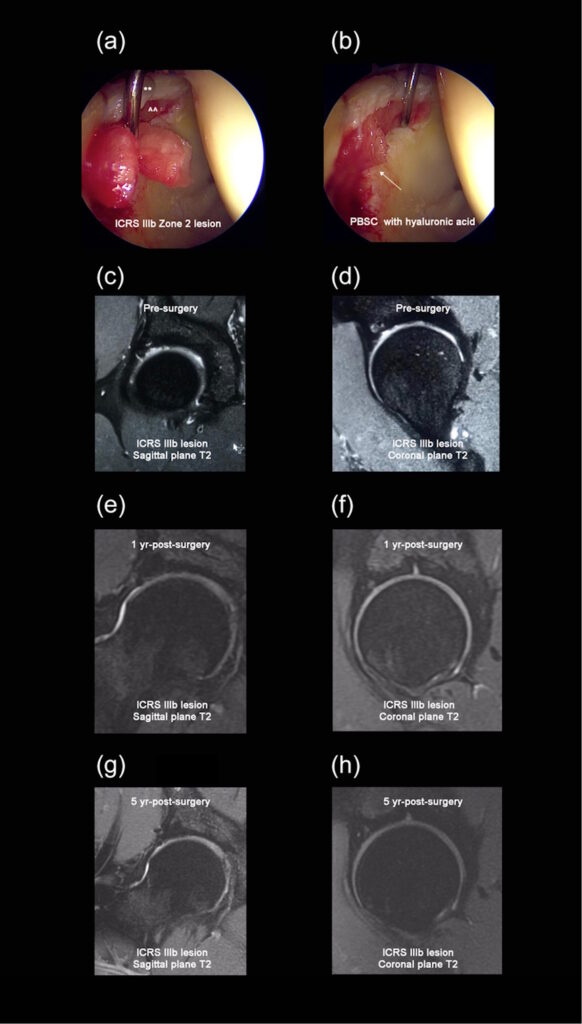
- En la condroreparación, se consideran técnicas cuyo objetivo es reparar defectos focales mediante estimulación del hueso subcondral (microfractura, perforaciones) o injertos osteocondrales, con resultados moderados en tejido de reparación (“fibrocartílago”). (PubMed)
- En la condrogeneración, los autores señalan que se trata de la “última frontera” de la medicina regenerativa: pretende restaurar cartílago hialino mediante implantes celulares, membranas, andamiajes, biotecnología. Sin embargo, los resultados a largo plazo aún son limitados y la evidencia sigue siendo principalmente a corto- y medio-plazo. (PubMed)
- También se destaca que la elección terapéutica depende fuertemente del perfil del paciente (edad, actividad, carga mecánica, malalineación, lesiones concomitantes) y de las características de la lesión (tamaño, profundidad, localización). (Mattioli 1885)
- Por último, los autores enfatizan la necesidad de optimizar los andamiajes (scaffolds), de buscar nuevas fuentes de condrocitos o células madre, y de generar evidencia con seguimiento más prolongado. (Mattioli 1885 Journals)
Discusión
En la discusión, los autores comentan que ninguna técnica por sí sola es actualmente la “solución perfecta” para todas las lesiones de cartílago de rodilla, y que el tratamiento debe individualizarse. (PubMed) Destacan las limitaciones comunes: sistema de Heil vascular limitado, integración del tejido reparado con el remanente articular, progresión hacia artrosis en algunos casos, insuficiente evidencia a largo plazo para los métodos más innovadores. (PubMed) Proponen que el futuro del tratamiento pasa por terapias combinadas (biomateriales + células + modulación mecánica), optimización de protocolos de rehabilitación, mejora de la selección de pacientes, y mejor diseño de estudios. (Mattioli 1885 Journals)
Conclusión (Conclusion)
El artículo concluye que el manejo de las lesiones de cartílago de rodilla ha avanzado significativamente, pero persisten retos importantes: la reparación durable del cartílago hialino, la integración con el hueso y tejido circundante, la prevención de la artrosis secundaria. Se recalca la importancia de una estrategia terapéutica escalonada, en la que la condroprotección y la condroreparación ocupan roles fundamentales, mientras la condrogeneración representa una prometedora área de futuro que requiere más evidencia. (PMC)
Palabras clave:
lesiones de cartílago, rodilla,
condroprotección, condroreparación, condrogeneración, medicina
regenerativa, técnicas quirúrgicas, injertos osteocondrales,
estimulación del hueso subcondral, andamiajes biológicos
Frase clave:
“Una estrategia terapéutica
escalonada que combine protección, reparación y regeneración es clave
para abordar de forma eficaz las lesiones de cartílago en la rodilla.”
The treatment of knee cartilage lesions: state of the art – PubMed
The treatment of knee cartilaginous injuries: state of the art – PMC
The treatment of knee cartilage lesions: state of the art | Acta Biomedica Atenei Parmensis
Talesa G, Manfreda F, Pace V, Ceccarini P, Antinolfi P, Rinonapoli G, Caraffa A. The treatment of knee cartilage lesions: state of the art. Acta Biomed. 2022 Aug 31;93(4):e2022099. doi: 10.23750/abm.v93i4.11740. PMID: 36043984; PMCID: PMC9534246.
This work is licensed under a Creative Commons Attribution 4.0 International License