Resumen
Antecedentes/Objetivos:
En los últimos años, se han logrado avances significativos en el
tratamiento de las lesiones del cartílago, lo que ha dado lugar a
diversas técnicas destinadas a la regeneración de la superficie
articular. Sin embargo, el impacto de la edad del paciente en los
resultados del tratamiento sigue siendo poco estudiado, a pesar de su
reconocida influencia en la efectividad. Muchos estudios imponen límites
superiores de edad, lo que resulta en datos limitados sobre pacientes
de mediana edad, un grupo que se somete frecuentemente a reparación del
cartílago. Se cree que los cambios fisiológicos relacionados con la
edad, incluyendo la disminución de la capacidad regenerativa y
alteraciones en la composición de proteoglicanos, afectan el éxito del
tratamiento. Este estudio investiga los resultados clínicos de la
reparación del cartílago en pacientes de 45 a 60 años, evaluando
específicamente la efectividad de la microfractura combinada con el
implante de la membrana Hyalofast. Métodos: Se evaluó a pacientes de 45 a
60 años sometidos a microfractura con implante de la membrana
Hyalofast. Los resultados a corto y mediano plazo se evaluaron mediante
los cuestionarios KOOS y SF-36 preoperatoriamente y en los seguimientos a
los 6 y 12 meses. Las evaluaciones funcionales y los análisis de
resonancia magnética fueron realizados por revisores expertos. Además,
se inició un programa de rehabilitación intensiva inmediatamente después
de la cirugía. El análisis estadístico se realizó mediante un ANOVA de
medidas repetidas de una vía para comparar los resultados
preoperatorios, a los 6 y 12 meses, con la prueba post-hoc de Tukey
aplicada para comparaciones múltiples. La significancia clínica se
evaluó mediante el tamaño del efecto d de Cohen, con umbrales estándar
para efectos pequeños, medianos y grandes. Resultados: El enfoque
combinado de microfractura y membrana Hyalofast, junto con la
rehabilitación temprana, arrojó resultados prometedores. Los beneficios
clave incluyeron reducción de la inflamación, mejor integración de la
membrana y disminución del edema subcondral. Conclusión: Estos hallazgos
respaldan la viabilidad de esta estrategia de tratamiento, destacando
su potencial para mejorar la función articular, aliviar el dolor y
mejorar la calidad de vida general en pacientes de mediana edad.
Introducción
Las
anomalías focales del cartílago en la rodilla pueden causar dolor y
discapacidad significativos [1, 2] y afectar la calidad de vida al mismo
nivel que la osteoartritis (OA) [3]. Debido a la limitada capacidad de
regeneración del cartílago articular, las anomalías del cartílago
frecuentemente derivan en OA [1]. Por lo tanto, las anomalías del
cartílago se han identificado como un predictor clave de la artroplastia
total de rodilla (ATR) en pacientes mayores de 45 años [4] y, por lo
tanto, el objetivo de la reparación del cartílago en la mediana edad es
retrasar o eliminar la necesidad de la ATR.
El envejecimiento del
cartílago implica procesos moleculares complejos que deterioran
gradualmente su estructura y función, reduciendo su resiliencia al
estrés mecánico y aumentando la susceptibilidad a la degeneración,
incluida la osteoartritis [5]. Estos cambios moleculares afectan la
matriz extracelular (MEC), las funciones celulares, las vías de
señalización y las interacciones entre el cartílago y las estructuras
circundantes (Fig. 1) [6]. Comprender estos mecanismos es esencial para
desarrollar terapias que frenen la degradación del cartílago. Los
proteoglicanos, en particular el agrecano, son macromoléculas vitales
dentro de la matriz extracelular (ECM) del cartílago que proporcionan
resistencia a la compresión y facilitan la retención de agua, esencial
para la resiliencia del cartílago [7]. El agrecano consiste en una
proteína central unida a numerosas cadenas de glicosaminoglicanos (GAG),
como el sulfato de condroitina y el sulfato de queratán [8]. Estas
cadenas de GAG altamente sulfatadas y con carga negativa atraen
cationes y moléculas de agua a través de la presión osmótica, lo que
permite que el tejido resista las fuerzas de compresión [9]. Con el
envejecimiento, los condrocitos producen menos agrecano y las
estructuras de las cadenas de GAG cambian, lo que reduce su capacidad
para retener agua [10, 11]. Enzimas como las condroitinasas degradan las
cadenas de sulfato de condroitina más rápidamente en el cartílago
envejecido, lo que compromete aún más la estructura de la matriz [12].
El ácido hialurónico (HA), un GAG grande no sulfatado sintetizado por
las hialuronano sintasas (HAS1, HAS2, HAS3), actúa como una estructura
principal para los agregados de proteoglicanos [9]. El envejecimiento
reduce la expresión de las enzimas HAS, disminuyendo la síntesis de HA
[13], mientras que el aumento de la actividad de las hialuronidasas
fragmenta las cadenas de HA [14]. Estos fragmentos de HA más cortos
forman agregados más débiles con agrecano, desestabilizando la matriz
extracelular (ECM) y aumentando su permeabilidad, lo que lleva a la
pérdida de componentes esenciales de la ECM y compromete la función del
cartílago [15, 16]. La red de colágeno, compuesta predominantemente de
fibrillas de colágeno tipo II, proporciona resistencia a la tracción y
mantiene el marco estructural del cartílago [17]. Los colágenos tipo IX y
XI se entrecruzan con el colágeno tipo II para estabilizar la red
fibrilar [18]. El envejecimiento reduce la síntesis de colágeno tipo II y
aumenta la expresión de colágeno tipo I, que es menos adecuado para la
función del cartílago [19]. La degradación del colágeno es impulsada por
las metaloproteinasas de matriz (MMP), particularmente MMP-1
(colagenasa-1), MMP-3 (estromelisina-1) y MMP-13 (colagenasa-3) [20].
MMP-13, que degrada específicamente el colágeno tipo II, está altamente
regulada positivamente en el cartílago envejecido [21]. La expresión de
MMP está regulada por citocinas inflamatorias (p. ej., IL-1β, TNF-α) y
estrés oxidativo, que activan factores de transcripción como NF-κB y
AP-1 [22]. Los productos finales de la glicación avanzada (AGE) se
acumulan en las fibras de colágeno a través de reacciones no
enzimáticas, formando enlaces cruzados que aumentan la rigidez y reducen
la solubilidad [23]. Los AGE interfieren con el recambio normal de
colágeno, reduciendo la susceptibilidad a las colagenasas y perjudicando
la remodelación de la matriz extracelular por los condrocitos [24].
Estas modificaciones debilitan el cartílago, haciéndolo menos capaz de
distribuir cargas y más vulnerable a microdaños [25]. Los condrocitos,
el único componente celular del cartílago, mantienen la homeostasis de
la matriz extracelular (ECM) equilibrando la síntesis y degradación [26,
27]. Los condrocitos envejecidos experimentan senescencia,
caracterizada por una detención irreversible del crecimiento,
resistencia a la apoptosis y el desarrollo de un fenotipo secretor
asociado a la senescencia (SASP) [28]. Los condrocitos senescentes
exhiben altos niveles de inhibidores del ciclo celular (p. ej.,
p16^INK4a y p21^CIP1) y acumulan marcadores de daño del ADN como γ-H2AX
[29]. El SASP implica la secreción de citocinas proinflamatorias (p.
ej., IL-6, IL-8), quimiocinas, factores de crecimiento y proteasas que
crean un microambiente proinflamatorio y promueven la degradación de la
ECM [30]. Los condrocitos senescentes aumentan la producción de MMP y de
una desintegrina y metaloproteinasa con motivos de trombospondina
(ADAMTS), en particular ADAMTS-4 y ADAMTS-5, que degradan el agrecano
[31]. Simultáneamente, la expresión de genes anabólicos, como COL2A1
(colágeno tipo II) y ACAN (agrecano), disminuye debido a cambios
transcripcionales y epigenéticos. Esta tendencia hacia el catabolismo
acelera la degradación de la matriz extracelular [32, 33]. El estrés
oxidativo resulta de un desequilibrio entre la producción de especies
reactivas de oxígeno (ROS) y la capacidad de defensa antioxidante [34].
Los condrocitos generan ROS, como el anión superóxido (O₂•⁻), el
peróxido de hidrógeno (H₂O₂) y los radicales hidroxilo (•OH), a través
de la fuga de la cadena de transporte de electrones mitocondrial, la
actividad de la NADPH oxidasa y la inflamación. El envejecimiento
deteriora la función mitocondrial, lo que lleva a un aumento de la
producción de ROS y una reducción de la síntesis de ATP [35, 36]. Las
ROS dañan las proteínas, los lípidos y el ADN, lo que altera las
funciones celulares y activa las respuestas al estrés [34]. El daño al
ADN inducido por ROS desencadena vías que involucran a p53 y otros
supresores tumorales, promoviendo la senescencia celular. Además, las
ROS activan factores de transcripción como NF-κB y AP-1, que potencian
la expresión de citocinas proinflamatorias (IL-1β, TNF-α), quimiocinas y
MMP, creando un ciclo de retroalimentación que exacerba el estrés
oxidativo y la inflamación [37–39]. Los condrocitos poseen sistemas
antioxidantes, como las superóxido dismutasas (SOD1, SOD2), la catalasa,
la glutatión peroxidasa y la tiorredoxina reductasa, que neutralizan
las ROS. Sin embargo, estas defensas se debilitan con la edad, lo que
aumenta la susceptibilidad al daño oxidativo y acelera la degeneración
del cartílago [40, 41].
El cartílago envejecido
presenta inflamación crónica, a menudo denominada «inflamación»,
caracterizada por un aumento de citocinas, quimiocinas y enzimas
degradativas. Mediadores clave como la IL-1β y el TNF-α alteran la
homeostasis de la matriz extracelular (MEC) al estimular las MMP y las
agrecanasas, a la vez que inhiben vías anabólicas como el factor de
crecimiento transformante beta (TGF-β) y el factor de crecimiento
similar a la insulina tipo 1 (IGF-1)[42, 43]. Estas citocinas activan
las vías NF-κB, MAPK y JAK/STAT, impulsando la inflamación y la
degradación de la MEC. Además, inducen la producción de óxido nítrico
(NO) a través de la óxido nítrico sintasa inducible (iNOS) y
prostaglandina E₂ (PGE₂) a través de la ciclooxigenasa-2 (COX-2), lo que
contribuye a la apoptosis de los condrocitos y a una mayor degradación
del cartílago [35, 38, 44]. La carga mecánica regula la salud del
cartílago mediante la mecanotransducción, que convierte las fuerzas
mecánicas en señales bioquímicas. Los condrocitos detectan estímulos
mecánicos mediante integrinas, canales iónicos y componentes del
citoesqueleto. Las integrinas conectan la matriz extracelular (ECM) con
el citoesqueleto de actina intracelular, activando vías de señalización
como PI3K/Akt y ERK, que favorecen la supervivencia de los condrocitos y
la síntesis de ECM [45–48]. Los canales iónicos activados por
estiramiento (SAC), como TRPV4 y los canales piezoeléctricos (Piezo1 y
Piezo2), median la entrada de calcio en respuesta al estrés mecánico. El
calcio intracelular regula la reorganización del citoesqueleto, la
expresión génica y las actividades anabólicas esenciales para el
mantenimiento del cartílago. Sin embargo, el envejecimiento deteriora la
capacidad de los canales iónicos mecanosensibles, lo que provoca una
señalización defectuosa del calcio y una menor capacidad de respuesta de
los condrocitos. El estrés mecánico excesivo activa p38 MAPK y JNK, lo
que regula positivamente las enzimas catabólicas y los mediadores
inflamatorios. La sobrecarga de calcio también puede desencadenar la
apoptosis de los condrocitos a través de las vías mitocondriales
[49–53]. La interfaz hueso-cartílago subcondral es crucial para la
función articular. El envejecimiento aumenta la rigidez del hueso
subcondral, la esclerosis y las microfisuras, alterando el entorno
mecánico del cartílago y promoviendo su degradación [54–56]. Las señales
bioquímicas de las células óseas subcondrales, como la esclerostina y
la DKK1, inhiben la señalización de Wnt/β-catenina en los condrocitos,
lo que altera los mecanismos de reparación del cartílago. La alteración
de la vascularización y el aporte de nutrientes debido a los cambios en
el hueso subcondral contribuye aún más a la degeneración del cartílago
[57–59]. Los cambios epigenéticos, como la metilación del ADN, las
modificaciones de las histonas y el ARN no codificante, regulan la
expresión génica en el cartílago envejecido. La metilación de genes
anabólicos (COL2A1 y ACAN) suprime su expresión, mientras que la
desmetilación de genes catabólicos (MMP-13 y ADAMTS-5) promueve la
degradación de la matriz extracelular (ECM). Las alteraciones
relacionadas con la edad en las modificaciones de histonas y los
perfiles de miARN contribuyen aún más a la degeneración del cartílago
[24, 60–64].
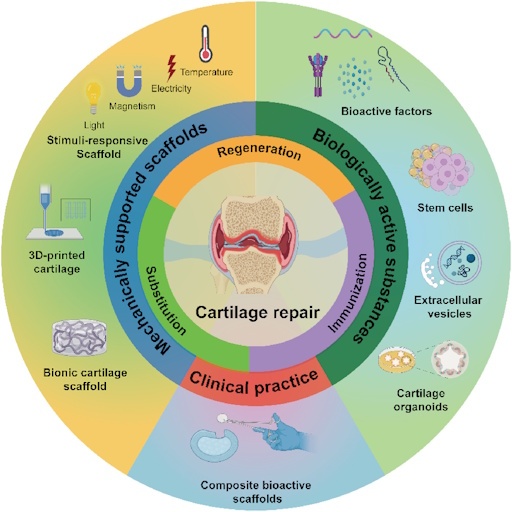
El tratamiento de las
lesiones de cartílago ha avanzado enormemente en los últimos años. Se
han desarrollado numerosas técnicas para regenerar la superficie
articular y se han validado resultados positivos en exámenes de
seguimiento a medio y largo plazo. Actualmente se utilizan tratamientos
paliativos (como la condroplastia), una amplia gama de procedimientos
regenerativos con diferentes grados de complejidad y diversas técnicas
de rejuvenecimiento del cartílago basadas en hueso. Los procedimientos
de estimulación de la médula ósea (BMS), como la artroplastia por
abrasión (AA), la microfractura (MF) [2, 65-68] y la condrogénesis
inducida por matriz autóloga (AMIC), son ejemplos de terapias
regenerativas [1]. El implante de condrocitos autólogos (ACI) [69-73] y
la concentración de aspirado de médula ósea (BMAC) [74-76] son
procedimientos basados en células. La reconstrucción biológica del
cartílago, mediante el trasplante de autoinjerto osteocondral y el
trasplante de aloinjerto osteocondral (OCA) [69, 77], así como la
reconstrucción de cartílago metálico y biosintético mediante implantes
de recubrimiento focal de rodilla (FKRI) [78, 79], se consideran
técnicas basadas en el hueso porque se basan en la osteointegración en
lugar de la condrogénesis [80]. Estos tratamientos juntos cubren el
rango actual de opciones quirúrgicas para la restauración del cartílago.
Sin embargo, estas terapias generalmente no consideran la edad del
paciente [2, 81–83], y no todos los pacientes pueden ser tratados con
estas terapias con buenos resultados [69, 84]. La edad se ha convertido
en uno de los rasgos más comúnmente reconocidos que es crítico para la
efectividad del tratamiento [70–72, 85]. Una restricción de edad
superior se utiliza con frecuencia como criterio de inclusión en los
estudios disponibles que evalúan la efectividad de la reparación del
cartílago [86]. A pesar del hecho de que entre el 52% y el 60% de los
procedimientos de cartílago se realizan en pacientes de entre 40 y 60
años [2, 87], pero el límite de edad común para la cirugía de
reconstrucción de cartílago presentado en la literatura es de 40 años
(el paciente ideal) [65, 72, 88]. Como resultado, los pacientes de
mediana edad están subrepresentados en la investigación. Algunos
estudios han encontrado que los pacientes mayores tienen un desempeño
deficiente [70-72, 85]. Se plantea la hipótesis de que el envejecimiento
tiene un efecto adverso en el cartílago articular al reducir su
capacidad única para regenerarse [88]. La estructura y composición de
los proteoglicanos en el cartílago también varían con la edad, lo que
reduce la concentración de sulfato de condroitina y la longitud del
filamento de hialuronato [70, 89]. Estos cambios relacionados con la
edad pueden respaldar una reacción adversa al tratamiento de pacientes
mayores, mientras que el verdadero impacto de estos cambios biológicos
en los síntomas del paciente y los resultados del tratamiento aún se
desconoce [70]. Un desafío importante al evaluar los resultados del
tratamiento en pacientes mayores es la dependencia de cuestionarios
respondidos por los pacientes, que son las herramientas más comúnmente
utilizadas para evaluar la mejora funcional. Estos cuestionarios
presentan limitaciones, ya que las puntuaciones más bajas en pacientes
mayores pueden reflejar diferencias relacionadas con la edad en la
función basal, en lugar de la eficacia del tratamiento. Esto introduce
un posible sesgo, ya que las personas mayores sanas suelen obtener
puntuaciones más bajas que sus contrapartes más jóvenes, incluso en
ausencia de patología. Además, un estilo de vida activo desempeña un
papel crucial en los resultados de la reparación del cartílago [70].
Un enfoque alternativo para
pacientes de mediana edad y mayores consiste en terapias regenerativas.
La literatura sugiere que, a diferencia de las técnicas de estimulación
de la médula ósea, cuya eficacia suele ser menor en pacientes mayores
debido a la disminución del potencial terapéutico con el envejecimiento,
las técnicas regenerativas pueden ofrecer mejores resultados en este
grupo de pacientes [65, 70]. El cultivo celular en andamios puede
activar factores anabólicos, induciendo la diferenciación de los
condrocitos y reduciendo la expresión y producción de moléculas
implicadas en la degeneración del cartílago. Esto respalda el posible
uso de tejidos bioingenierizados para facilitar la reparación tisular,
especialmente en el tratamiento de pacientes mayores [70], como la
membrana Hyalofast utilizada en este estudio. En consecuencia, la
condrogénesis autóloga inducida por matriz (AMIC) se ha popularizado en
los últimos años. Este enfoque consiste en la implantación de un andamio
biodegradable con microfracturas. Debido a su rentabilidad y
eficiencia, este método se utiliza cada vez más, y los resultados
clínicos recientes indican una mejora significativa de la función y la
calidad de vida en los períodos de seguimiento a medio y largo plazo
[90–93].
Entre los andamios
biocompatibles disponibles comercialmente para la reparación del
cartílago, Hyalofast, que también se utiliza en este estudio, destaca
por su estructura tridimensional y su bioactividad, biocompatibilidad y
biodegradabilidad. Forma una matriz que sirve de soporte estructural
para las células madre mesenquimales liberadas por los huesos
estimulados. Hyalofast promueve la proliferación y diferenciación de
estas células en condrocitos. Además, durante la degradación de esta
membrana, se libera una mayor cantidad de ácido hialurónico, creando un
microambiente que facilita aún más la regeneración del cartílago dañado
[90, 91, 94]. Actualmente, estudios limitados evalúan los resultados a
corto y mediano plazo del tratamiento de lesiones condrales de rodilla
con microfracturas en combinación con la implantación de andamios de
ácido hialurónico, considerando la amplia variedad de andamios
biológicos disponibles. Este estudio tiene como objetivo evaluar los
resultados clínicos a corto y mediano plazo en pacientes de 45 a 60 años
con lesiones condrales de rodilla de grado IV que se sometieron a
microfracturas con implante de andamio de ácido hialurónico. Además, los
pacientes iniciaron un programa intensivo de rehabilitación el primer
día después de la cirugía. Los resultados se evaluaron mediante
evaluaciones subjetivas de los pacientes a través de dos cuestionarios
(KOOS y SF-36) antes de la cirugía y a los 6 y 12 meses de seguimiento,
junto con la evaluación funcional y observaciones de resonancia
magnética realizadas por un equipo calificado. Planteamos la hipótesis
de que el uso de andamios de ácido hialurónico y microfracturas
conducirá a resultados clínicos satisfactorios y facilitará un retorno
temprano a las actividades diarias en pacientes de mediana edad.
Conclusión
En este
estudio, evaluamos los resultados del tratamiento de defectos de
cartílago en personas de 45 a 60 años mediante la técnica de
microfractura combinada con la membrana Hyalofast. El objetivo principal
fue evaluar la eficacia de este enfoque para mejorar la función
articular y la calidad de vida en este grupo de edad. Nuestros hallazgos
indican que la reparación del cartílago en pacientes de mediana edad no
solo es factible, sino que también produce mejoras clínicas
significativas. Una de las observaciones clave fue la notable reducción
de los síntomas inflamatorios en torno al defecto del cartílago. La
resonancia magnética postoperatoria reveló que la respuesta inflamatoria
fue mínima o casi inexistente, lo que destaca la eficacia del
tratamiento para modular la inflamación, un factor crucial para la
cicatrización tisular. Además, observamos que la membrana Hyalofast se
integró con éxito con las estructuras cartilaginosas circundantes, lo
que sugiere su potencial para mejorar la reparación del cartílago y
restaurar la funcionalidad articular. Otro hallazgo significativo fue la
reducción del edema en la capa subcondral, lo que indica una
cicatrización progresiva de la herida. Esto concuerda con las
expectativas, ya que la disminución del edema suele asociarse con una
mejor reparación tisular y regeneración del cartílago. En general,
nuestros resultados respaldan el uso de microfracturas combinadas con un
armazón a base de ácido hialurónico como una estrategia eficaz para la
reparación del cartílago en pacientes de mediana edad, mejorando
potencialmente la salud de las articulaciones a largo plazo y los
resultados funcionales.